Dans la cellule eucaryote, les protéines sont, dans leur grande majorité, codées par le génome nucléaire et produites dans le cytosol. Ces protéines sont ensuite acheminées dans le comportement cellulaire (mitochondrie, chloroplaste, réticulum…) dans lequel elle joueront leur rôle. Afin d’être correctement adressées, il existe des signaux portés par ces protéines (peptides d’adressage) localisés, dans le cas des chloroplastes et des mitochondries, en position N-terminale. Certaines de ces protéines peuvent être localisées dans plusieurs compartiments, soit simultanément soit uniquement dans certaines conditions de développement ou d’environnement (stress par exemple). Plusieurs mécanismes ont été identifiés qui permettent de réguler de tels adressages multiples :
• l’initiation différentielle de la transcription ou de la traduction
• l’élimination par épissage alternatif de la séquence codant pour les peptides d’adressage.
Une
équipe de notre laboratoire, en étudiant la biotinylation des protéines chez les plantes, a mis en évidence un nouveau mécanisme de régulation d’un adressage multiple d’une protéine.
La biotinylation des protéines est une modification post-traductionnelle très spécifique compartimentée dans la cellule végétale entre la mitochondrie, le plaste et le cytosol. Cette réaction, catalysée par l’holocarboxylase synthétase (HCS) modifie et active un petit nombre de carboxylases jouant un rôle clé dans le métabolisme cellulaire, en particulier la synthèse des acides gras. Cependant, les bases moléculaires de cette compartimentation complexe ainsi que l’implication respective de chacun des deux gènes
HCS (HCS1 et
HCS2) identifiés chez
Arabidopsis thaliana par cette équipe sont peu comprises
[1].
Récemment, ces chercheurs ont pu montrer par une approche de
génétique inverse que le gène
HCS1 était essentiel à la vie de la plante (l’inactivation du gène est létale à un stade très précoce du développement embryonnaire) alors qu’une interruption du gène
HCS2 chez cette plante modèle n’avait aucune conséquence sur sa croissance et son développement. Ces observations suggèrent fortement que la protéine HCS1 est seule responsable de la biotinylation et donc l’activation des carboxylases dans les différents compartiments de la cellule végétale (cytosol, chloroplaste et mitochondrie). Une analyse détaillée de l’expression du gène
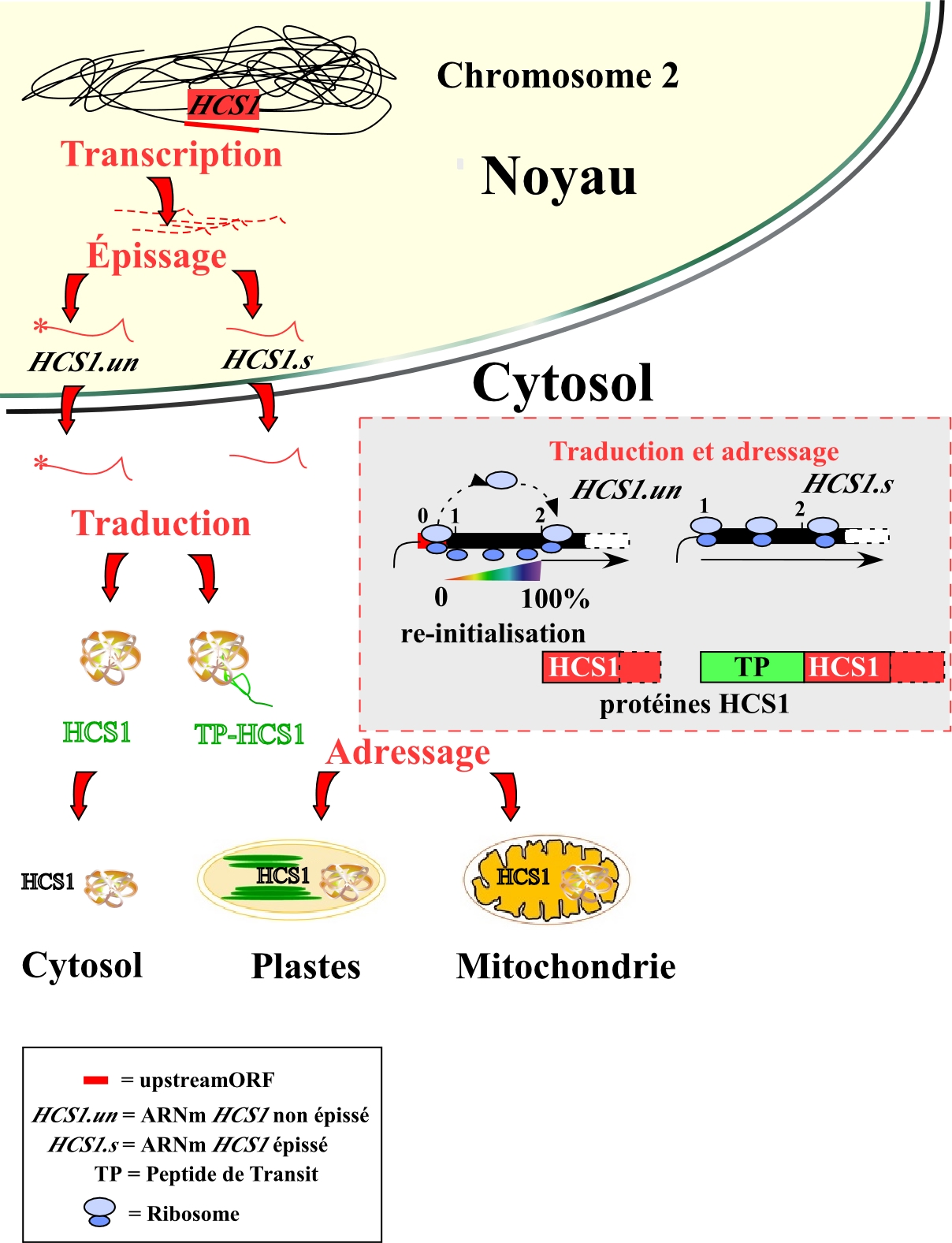
HCS1 a permis alors à ces chercheurs de proposer un mécanisme original permettant d’expliquer cette multiplicité de localisations. Ils ont pu en effet identifier au niveau de l’extrémité 5’ non codante de l’ARNm de
HCS1 une petite phase ouverte de lecture (upstreamORF) qui régule de manière qualitative et quantitative l’initiation de la traduction de la protéine HCS1, contrôlant ainsi sa localisation ultime dans la cellule. De manière inattendue, ils ont également mis en évidence que l’activité régulatrice de cette structure était elle-même contrôlée par son élimination (ou non élimination) physique par un mécanisme de maturation différentielle connu sous le nom d’épissage alternatif
[2] .
Ainsi, au-delà du cas de la protéine HCS1, ces résultats mettent en évidence un nouveau mécanisme de contrôle de l’adressage d’une même protéine dans différents compartiments de la cellule eucaryote et permettent d’éclairer d’un jour nouveau la compréhension des mécanismes cellulaires complexes assurant la compartimentation du métabolisme.
Au-delà de l’aspect purement fondamental, cette découverte peut s’avérer également très intéressante dans l’optique du développement de nouveaux outils visant à contrôler l’adressage intracellulaire de protéines recombinantes d’intérêt biotechnologique.
Génétique inverse : une manière de découvrir la fonction d’un gène est d’obtenir une mutation de perte de fonction de ce gène, et d’analyser le phénotype du mutant qui en résulte. Si ce type d’approche est réalisé efficacement chez les bactéries et la souris en remplaçant le gène sauvage par un allèle muté (par recombinaison homologue), cela n’est pas possible chez les plantes. Une alternative, efficace et largement utilisée chez Arabidopsis, est le criblage de collections de plantes mutagénisée avec un élément d’insertion mobile (transposons) ou stable (ADN-T).