Des petits ARN non-codants (ARNnc) existent dans tous les règnes du vivant. Ils régulent l'expression génique via des phénomènes tels l’ARN interférence, les « silencing » transcriptionnel et post-transcriptionnel. En général, ils agissent sur l’expression des ARNs cibles par appariement en agissant comme ARN anti-sens. Peu de données sont disponibles concernant la régulation par les ARN anti-sens dans les organites semi-autonomes, les mitochondries et les plastes. C’est à cette tâche que s'attelle l’équipe « Expression du génome plastidial » du Laboratoire Physiologie Cellulaire & Végétale en étudiant la régulation de l’expression génétique dans les chloroplastes de la plante modèle, Arabidopsis thaliana.
L’ADN plastidial est une petite molécule d’environ 150 000 paires de bases sur laquelle 120 gènes environ sont localisés sur les deux brins et organisés en opérons (
Figure). La transcription de certains gènes et une terminaison inefficace peuvent produire des ARN anti-sens contre les ARN produits sur le brin d’ADN complémentaire. L’arrangement de l’opéron psbB (encadré rouge de la figure) a attiré notre attention. En effet, cet opéron comprend cinq gènes dont trois codent des protéines impliquées dans le photosystème II et deux codent des protéines participant au transport d’électrons. Sur le brin opposé à cet opéron est situé le gène
psbN dont ni la fonction de la protéine ni sa localisation intra-plastidiale sont connues. Ainsi, la transcription de
psbN pourrait produire un ARN messager formant un ARN anti-sens avec l’ARNm de l’opéron
psbB.
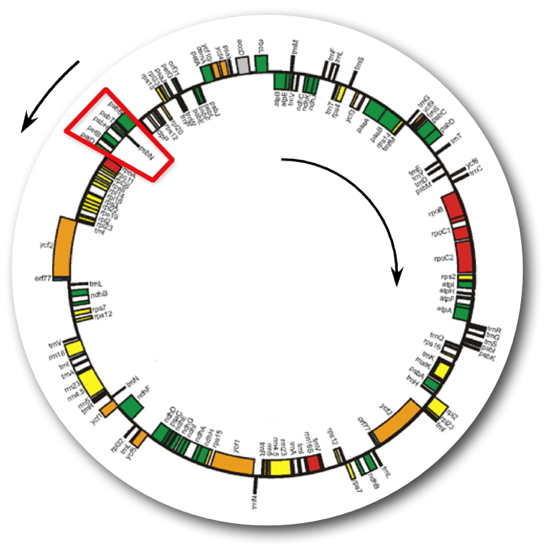
ADN chloroplastique d'Arabidopsis thaliana, 154 312 paires de base.
La transcription des gènes de l'ADN chloroplastique se fait dans le sens horaire (cercle intérieur) et dans le sens inverse des aiguilles d'une montre (cercle extérieur). Ces gènes sont impliqués dans la transcription (en rouge), la traduction (en jaune), la photosynthèse (en vert), les ARN de transfert (en noir), et en gris dans d'autres fonctions. En orange sont représentés les gènes dont la fonction est inconnue.
Pour étudier le fonctionnement de cette région, nous sommes partis de données antérieures [1] montrant que la transcription du gène psbN est totalement dépendante du facteur SIG3 codé dans le noyau et importé dans le chloroplaste. Dans cette nouvelle étude [2], ils utilisent un mutant sig3 n’exprimant pas psbN, et montrent que le double brin psbT sens/psbT anti-sens est absent dans ce mutant. Il en résulte alors que la quantité de protéine PSBT augmente car l’ARNm psbT ne peut plus être séquestré par l’anti-sens.
À quoi ce contrôle par l’anti-sens peut-il servir ? Une première réponse est proposée par ces chercheurs. En effet, un stress photo-oxydatif conduit à une diminution générale des ARNm plastidiaux, à l’exception de l’ARN anti-sens
psbT ! Ceci suggère une fonction générale aux ARN anti-sens plastidiaux. Le maintient des ARN double brins protégerait certains ARN essentiels d’une dégradation nucléolytique induite par un stress lumineux.
Ces résultats représentent la première caractérisation fonctionnelle d’un ARN anti-sens dans les plastes. L’approche consistant à utiliser un mutant n'exprimant pas un facteur de transcription codé dans le noyau pour de telles études, est une stratégie nouvelle et prometteuse dans l’analyse fonctionnelle des ARNnc plastidiaux.
Le plaste est un organite présent dans les cellules des eucaryotes chlorophylliens (algues et plantes). Il est dit semi-autonome car il possède son propre génome. Suivant la cellule, les plastes peuvent se spécialiser pour accomplir certaines fonctions, ainsi les chloroplastes sont le siège de la photosynthèse, les amyloplastes sont spécialisés dans la synthèse d'amidon. De nombreux types de plastes sont connus tels les proplastes, les chloroplastes, les amyloplastes…
Le chloroplaste est également le siège de la synthèse de lipides, de polymères de sucres et d’hydrogène. L’un des objectifs de ces études est de produire des données fondamentales en amont de domaines applicatifs potentiels en lien avec les bioénergies.