La tyrosine est synthétisée, selon les organismes, soit par une arogénate déshydrogénase, soit par une préphénate déshydrogénase. Les arogénate/ préphénate déshydrogénases présentent une très grande diversité dans leur spécificité de substrats et dans leur mécanisme de régulation, ce qui rend leur étude structurale comparée très attractive.
En collaboration avec le groupe Synchrotron du laboratoire de Cristallographie et de Cristallogenèse des Protéines de l'Institut de Biologie Structurale, nous avons résolu la structure cristallographique, à 1,6 Å de résolution, de l'arogénate déshydrogénase de Synechocystis en présence de NADP.
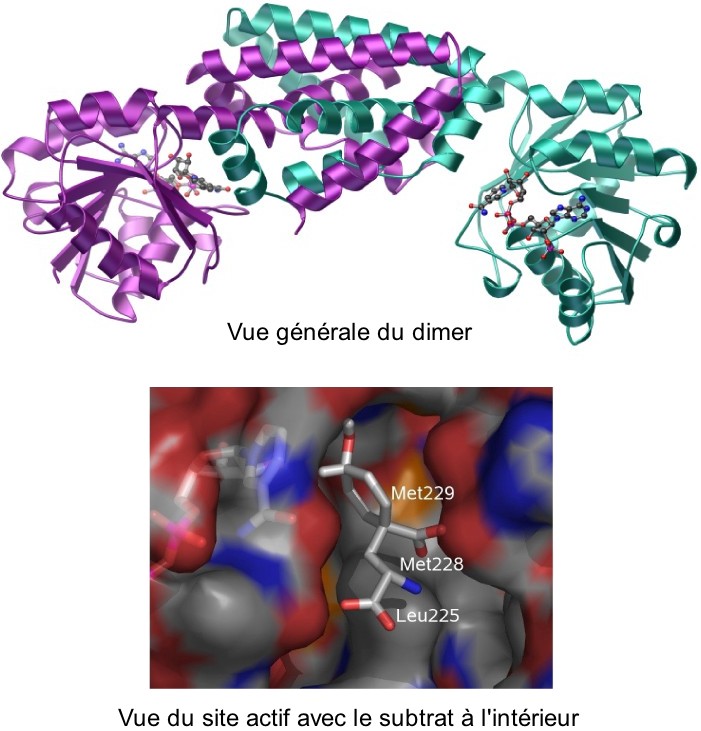
Cette première détermination de structure 3D va permettre d'analyser au niveau moléculaire les déterminants de la spécificité de substrat et les mécanismes de régulation des différentes arogénates/ préphénates déshydrogénases. Cette étude a des implications importantes dans la recherche de nouvelles molécules antibiotiques ou herbicides. D'autre part, ces enzymes étant situées au point de branchement entre synthèse de tyrosine et de phénylalanine, cette étude ouvre des perspectives biotechnologiques liées à la modulation du partage des flux de carbone entre ces deux acides aminés aromatiques.