La 4-hydroxyphénylpyruvate dioxygénase (HPPD) est la cible moléculaire d’herbicides très efficaces. Du fait de son implication dans la dégradation de la tyrosine, les inhibiteurs de l'HPPD sont également utilisés comme agents thérapeutiques pour lutter contre les effets létaux associé à la Tyrosinémie de type I. Ils empêchent l’accumulation de molécules hautement toxiques issues de la dégradation de l’homogentisate. Ces inhibiteurs font également l’objet d’essais cliniques dans le traitement de la maladie de Parkinson en réduisant la dégradation de la tyrosine, un précurseur de la dopamine. Malgré son intérêt phytosanitaire et pharmaceutique, le mécanisme réactionnel de l’HPPD n’a pas encore été entièrement élucidé. L'HPPD catalyse la conversion du 4-hydroxyphénylpyruvate en homogentisate (HGA). Chez la plupart des organismes, l’HPPD est impliquée dans la dégradation de la tyrosine, mais chez les organismes photosynthétiques l’HGA est le précurseur aromatique des vitamines E et des plastoquinones, molécules indispensables au fonctionnement photosynthétique et à la lutte contre le stress oxydant. Dans une étude basée sur la structure 3D de l’enzyme d’
Arabidopsis (
1SQD), combinant une approche de mutagenèse dirigée réalisée par des chercheurs de notre laboratoire et soutenue par des calculs théoriques de mécanique quantique/mécanique moléculaire (
QM/MM) réalisés par des chercheurs du laboratoire Chimie et Biologie des Métaux de notre institut (
Figure), le rôle des résidus catalytiques susceptibles d'interagir avec le substrat et les intermédiaires réactionnels a pu être déterminé. Ces résultats mettent en évidence :

le rôle central de Q272 Q286 Q358 dans la formation du complexe enzyme-substrat et dans la première attaque nucléophile,

l'important mouvement du noyau aromatique de l'HPP au cours de la réaction,

le rôle clé joué par N261 et S246 dans l'hydroxylation du C 1 et le réarrangement final de la chaîne latérale.
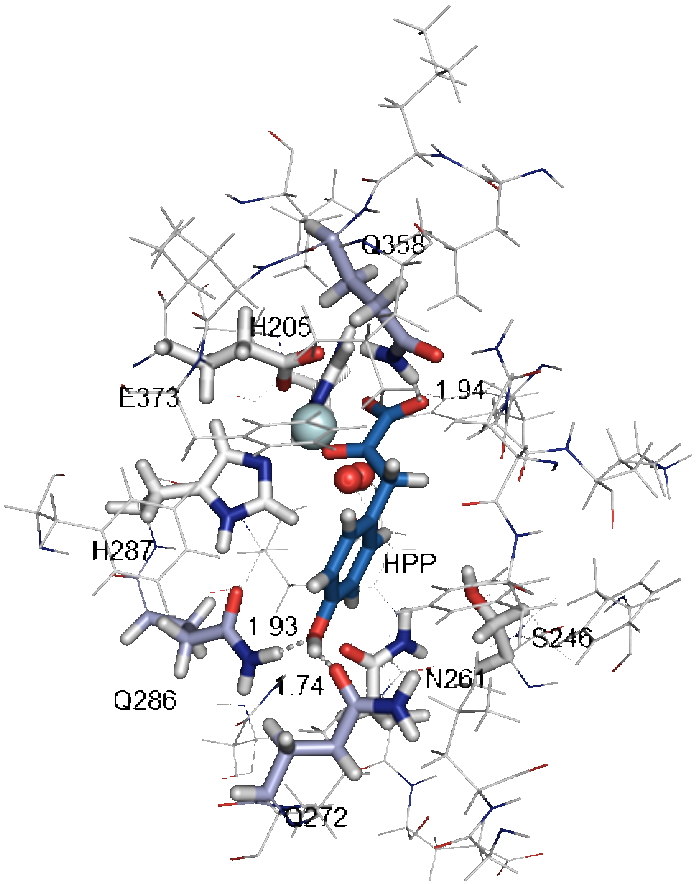
Structure du complexe ternaire enzyme-HPP-O2 basée sur les calculs théorique QM/MM prenant en compte les résultats de mutagenèse dirigée mettant en évidence le rôle des résidus Q358 Q286 et Q272 dans la formation de ce complexe. Le fer est en cyan le dioxygène en rouge et l’HPP en bleu.