Pour mieux comprendre les phénomènes allant de l’acquisition de forme au mouvement cellulaire, l'équipe CytoMorphoLab de notre laboratoire a observé en microscopie à onde évanescente (méthode hautement résolutive), la génération d’un réseau spécifique de filaments d’actine en temps réel. In vivo, c’est l’assemblage coordonné de ces polymères biologiques qui est directement responsable de la production de force de poussée qui déforme puis propulse la membrane plasmique et engendre ainsi le déplacement de la cellule.
Ces chercheurs ont utilisé comme outil biomimétique des fibres de verre ou des billes de polystyrène rendues motiles grâce à l’auto-assemblage spontané d’un réseau d’actine à leur surface (
Figures 1 et 2). De façon surprenante, l’observation et la modélisation mathématique extensive des données expérimentales (
Figure 2), ont démontré sans ambiguïté et contrairement au modèle préétabli, que la production de force ne résultait pas nécessairement d’une architecture imposée et contrainte de ce réseau. Bien au contraire, la génération de force repose sur des lois physiques simples et fondamentales. Elle est la conséquence de l’allongement spontané selon une orientation libre des polymères d’actine issus d’un réseau précurseur. L’augmentation de matière due à l’assemblage de ce polymère biologique au sein d’un volume limité et
in fine saturé, engendre la force de poussée de la particule biomimétique et, par extension, de la membrane cellulaire.
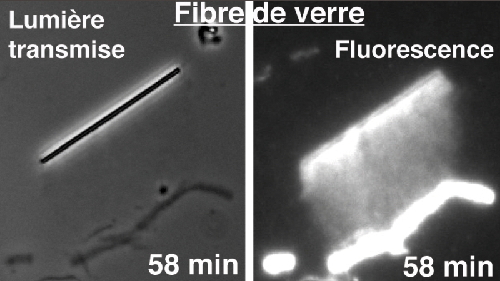
Figure 1. Reconstitution in vitro de l'assemblage d'un réseau de filaments d'actine à la surface d'une fibre de verre, dans un milieu constitué de protéines purifiées. Ce réseau, observé simultanément en lumière transmise et en épifluorescence, génère une force suffisante pour propulser l'objet bio-mimétique dans ce milieu. Les images révèlent le réseau polymérisé en 58 minutes. La flèche indique le sens de déplacement de la baguette de verre.