Le cytosquelette des cellules eucaryotes est formé d’un réseau complexe de polymères biologiques, dont un composant majeur est constitué par les filaments d'actine. Ces filaments sont impliqués dans le maintien de l’intégrité architecturale cellulaire (Figure 1). De plus, le réseau dynamique formé par auto-assemblage de ces filaments produit des forces suffisantes pour permettre à la cellule d’effectuer des mouvements coordonnés et dirigés en réponse aux signaux extracellulaires [4]. La polymérisation spatialement contrôlée de l’actine est médiée par des protéines du cytoplasme. Ces protéines contrôlent non seulement la dynamique des filaments d’actine, mais aussi sont capables d’organiser les filaments dans des structures hautement ordonnées (par exemple les réseaux ou les câbles), qui sont fondamentales pour la génération de force (Figures 1 et 2).
L’ordre de grandeur des forces à l’échelle de la cellule a été estimé au nano Newton, alors que la force par filament serait de l’ordre du pico Newton.
L’objectif des projets de recherche de l'équipe CytoMorphoLab de notre laboratoire est de comprendre comment la dynamique du filament d’actine individuel est intégrée à l’échelle de la cellule pour produire forces et mouvements. Pour cela ces chercheurs veulent comprendre l’ensemble des réactions moléculaires permettant la polymérisation des monomères d’actine en filaments et l’émergence de structures macroscopiques dynamiques (réseau dendritique ou câbles de filaments d’actine, Figure 1) responsables de la déformation des cellules et de leur motilité.
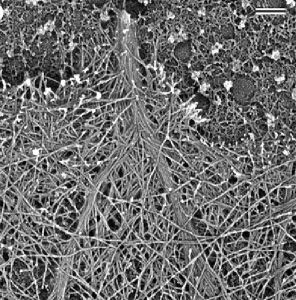
Figure 1 : Cliché de microscopie électronique permettant de visualiser l’organisation des filaments d’actine au bord avant d’une cellule motile [6].
À terme, cette connaissance sera utile dans le cadre des pathologies associées aux dysfonctionnements cellulaires liés à une modification des propriétés mécaniques des cellules, notamment en embryologie, en cancérologie ou dans le cadre des maladies neurodégénératives.
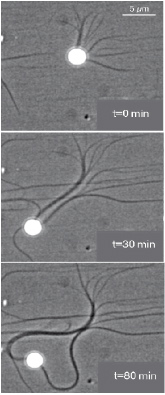
Figure 2 : Bille de polystyrène (2 µm) propulsée par des filaments d’actine dans un système biochimiquement contrôlé [3] (Microscopie à contraste de phase).
En combinant des systèmes biomimétiques capables de reproduire in vitro la motilité par polymérisation de l'actine (Figure 2) avec la microscopie à onde évanescente (TIRF microscopie, Figure 3) cette équipe a pu étudier la dynamique de l'actine à l'échelle moléculaire. Les objets biomimétiques sont recouverts par des protéines activatrices de la polymérisation de l’actine et placés dans un milieu biochimiquement contrôlé (Figures 2 et 3).
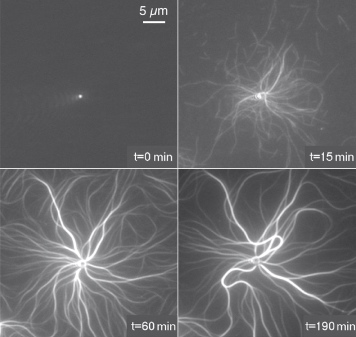
Figure 3 : La force engendrée par polymérisation de l’actine autour d’une bille de polystyrène (2µm) immobilisée est responsable du flambage (déformation) des câbles d’actine [3]. (Microscopie à onde évanescente)
La microscopie à onde évanescente permet de suivre en temps réel des filaments d’actine individuels à l’intérieur de structures ordonnées d’actine [2].
Ainsi, il est possible de comprendre comment des processus apparemment aléatoires (polymérisation-dépolymérisation des filaments) permettent une organisation des filaments d’actine en une structure macroscopique (Figure 3). La précision des mesures et la reproductibilité de ces événements élémentaires permettent de contraindre des modèles à la fois cinétiques et mécaniques de la génération de force par polymérisation de l’actine (collaboration avec Jean-Louis Martiel, TIMC-IMAG [1, 5]).
Les travaux récents de cette équipe ont permis de reconstituer et de visualiser en temps réel la dynamique stochastique des filaments d'actine, et de démontrer que l'hydrolyse du nucléotide lié à l'actine joue le rôle “d'horloge interne” du filament d'actine, permettant au facteur de dépolymérisation (l'ADF/cofiline) de sélectionner les portions des filaments à préserver ou déstabiliser (Figure 4). Cette propriété lorsqu’elle est associée à un processus de sélection qui permet de stabiliser les câbles de filaments d'actine par interactions mécaniques, peut être à l'origine de nombreuses structures cellulaires actine dépendantes.
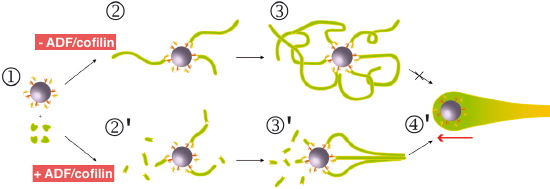
Figure 4 : Modèle moléculaire de l'émergence d'une force macroscopique par polymérisation d'actine. En absence d’ADF/cofiline et en présence de monomères (étapes 1, 2 et 3) la polymérisation d’actine se fait de façon isotropique autour de la bille recouverte d’un facteur de nucléation de l’actine (la formine). L’ADF/cofiline (étapes 2’, 3’ et 4’) permet grâce à un processus de sélection, la brisure de symétrie du réseau isotrope d’actine (étape 3’) et puis le mouvement (étape 4’).