Le terme folate(s) désigne un ensemble de molécules ayant pour structure de base l’acide folique (ou acide ptéroylglutamique, vitamine B9). Il s’agit d’une molécule composée de trois parties distinctes : un noyau ptérine, un acide para-aminobenzoïque (pABA) et une chaîne (poly)glutamate (Figure 1). Le chef de file de cette famille est le tétrahydrofolate dont le rôle est le transport d'unités monocarbonées. Il est le cofacteur central du métabolisme C1, métabolisme impliqué, entre autres, dans la synthèse des acides nucléiques et de la méthionine, et dans le cycle des méthylations.
Compte tenu de l’importance des voies métaboliques concernées, une baisse de la concentration en folates peut entraîner un arrêt de la division et, éventuellement, la mort cellulaire. C’est pourquoi une déficience en folates peut avoir de graves répercussions sur la santé animale (anémies, malformation du tube neural, cancers, maladies cardio-vasculaires et neurodégénératives). C'est également la raison pour laquelle de nombreux médicaments à propriétés antibiotiques et antiparasitaires sont basés sur une inhibition de la voie de biosynthèse de ces cofacteurs. Toutefois, seules deux enzymes sur les onze de cette voie sont actuellement ciblées : la dihydroptéroate synthase et la dihydrofolate réductase (
Figure 2, réactions 8 et 10). L’apparition régulière de résistances à ces drogues conduit à chercher de nouvelles molécules afin de remplacer celles devenues inefficaces et à identifier de nouvelles cibles.
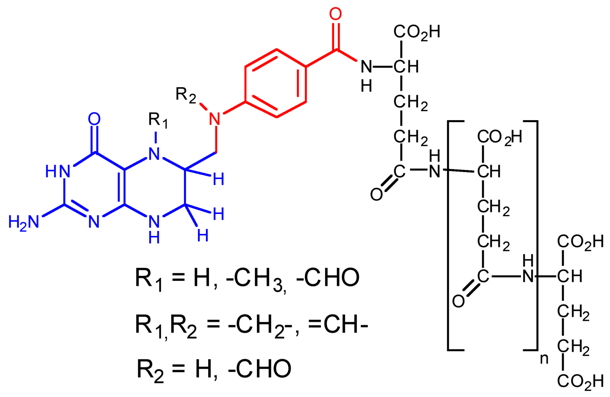
Figure 1 : Structure du tétrahydrofolate (THF) et unités C1 transportées. En bleu le noyau ptérine, en rouge le pABA et en noir la chaîne polyglutamate. Chez les plantes, les unités C1 sont inter-convertibles.
Nous nous sommes intéressés aux enzymes responsables de la formation du pABA (
réactions 5 et 6, figure 2). En effet, cette partie de la voie de biosynthèse, absente chez l’homme, a été peu étudiée jusqu’à présent et représente une cible potentielle pour de nouvelles molécules à propriétés antibiotiques, herbicides ou antiparasitaires.
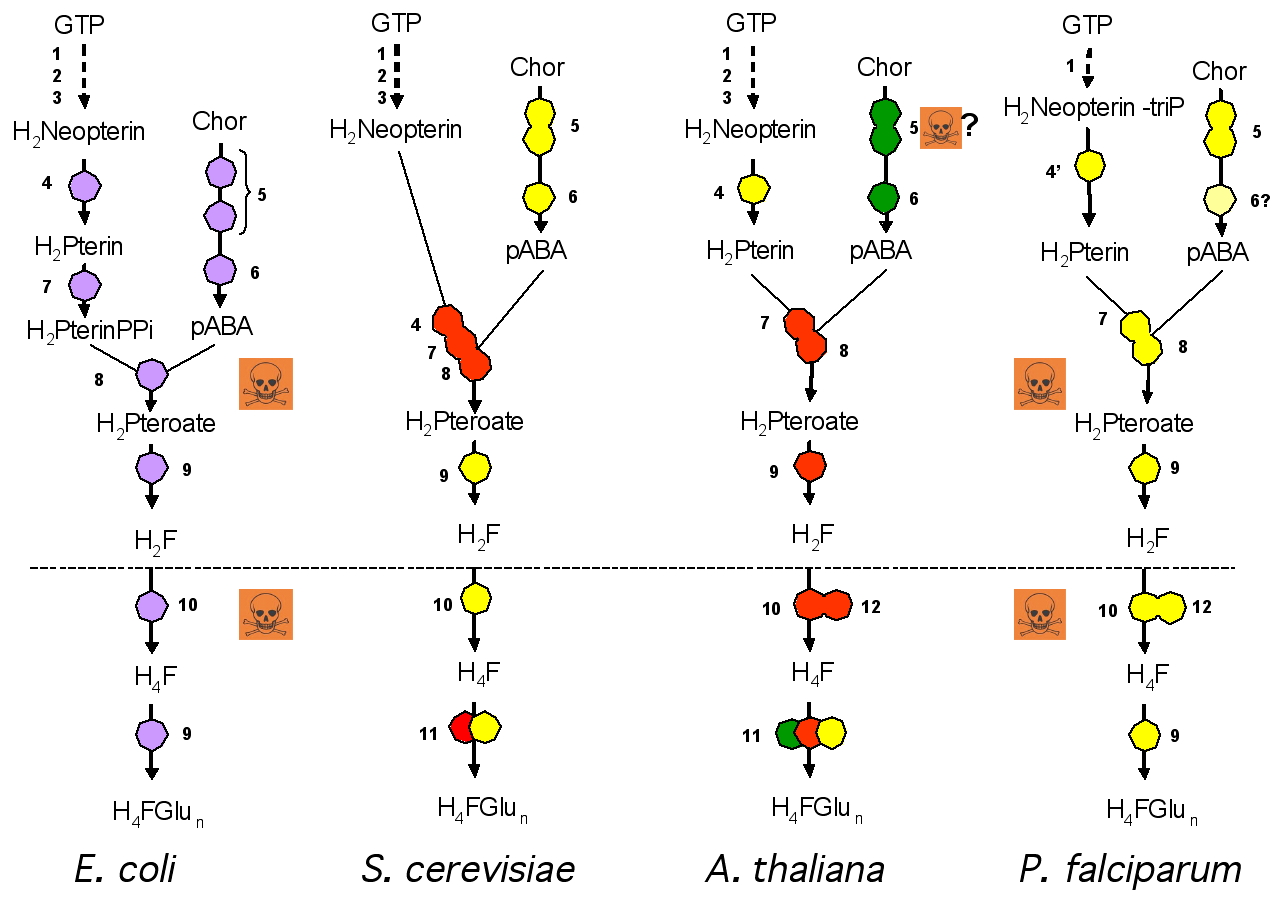
Figure 2 : Représentation schématique de la biosynthèse du THF (H4FGlun) chez différents organismes. Les étapes 4 à 9 sont absentes chez l’animal. Les cercles fusionnés représentent des enzymes multifonctionnelles. Les enzymes en jaunes sont présentes dans le cytosol, en vert, dans le chloroplaste, en rouge, dans la mitochondrie. Il s’agit d’une localisation encore prédictive chez la levure et Plasmodium. Chez Plasmodium, l’enzyme 6 n’a pas encore été identifiée.
La comparaison de cette voie entre différents organismes autotrophes pour le folate montre que chez les eucaryotes, contrairement aux procaryotes, la première étape est toujours catalysée par une enzyme bifonctionnelle. Dans cette nouvelle étude, nous avons étudié l’enzyme de plante en tant que modèle eucaryote. Cette enzyme (GAT-ADCS) est une glutamine amidotransférase (GAT) / aminodéoxychorismate synthase (ADCS). Le domaine GAT catalyse l’hydrolyse de la glutamine en glutamate et transfert le groupement NH
3 ainsi libéré vers le domaine ADCS qui, à son tour, substitue le groupement hydroxyle en C4 du chorismate par cette fonction amine (
Figure 3).
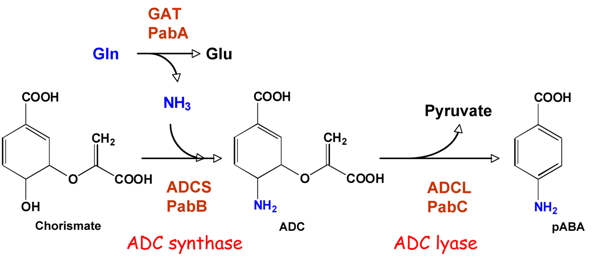
Figure 3 : La synthèse de pABA. A, réactions impliquées dans la transformation du chorismate en pABA ; ces deux étapes sont catalysées par une ADC synthase (PabA et PabB chez E. coli) et une ADC lyase (PabC chez E. coli).
À l’aide d’approche diverses, incluant la RMN, nous avons pu montrer que chaque domaine peut fonctionner de façon indépendante, mais que le fonctionnement en tandem améliore les constantes cinétiques de chacun d’eux. Ils ont également montré que le NH
3 utilisé pour la synthèse de l’ADC ne s’équilibre pas avec le milieu extérieur, mais est canalisé vers le domaine ADCS. Ce transfert de NH
3 et/ou la réaction d’amination du chorismate sont les facteurs limitant de ce système enzymatique. Finalement nous avons observé que l’accumulation d’ADC rétro-inhibe l’activité ADCS et que de fortes activités exigent que l’ADC produit soit en permanence soustrait du milieu par la réaction suivante catalysée par l’ADC lyase.
Les connaissances acquises sur ce système enzymatique nous ont permis de mettre au point une méthode simple et robuste de dosage de l’activité GAT-ADCS, compatible avec une plate-forme robotisée de criblage à haut débit pour la recherche d’inhibiteurs. Une molécule active sur l’enzyme
in vitro, sur la croissance de plantules d’
Arabidopsis thaliana et sur la prolifération de
Toxoplasma gondii et de
Plasmodium falciparum a été identifiée. Elle est actuellement en cours d’étude.