Les microalgues sont des algues microscopiques généralement unicellulaires, qui vivent en eau douce ou salée. Au cours de l’évolution elles ont colonisé tous les biotopes exposés à la lumière. Elles jouent un rôle prépondérant dans le processus d’assimilation du carbone inorganique dans la chaîne trophique, et plus généralement dans les cycles biogéochimiques des lacs et océans. Grâce à leur capacité d’accumulation et de conversion de la biomasse en molécules à forte valeur ajoutée, elles constituent un domaine de recherche de plus en plus exploité.
Du fait de leur localisation cosmopolite, les microalgues sont exposées à des contraintes environnementales très importantes : variations de température, disponibilité en nutriments et en lumière... Ainsi, en condition de lumière limitante elles doivent améliorer leur capacité d’absorption. À l’opposé, lorsque la quantité de lumière disponible dépasse la capacité d’utilisation photosynthétique, elles doivent limiter leur capacité d’absorption au niveau du
photosystème II (PSII). Jusqu’à présent, deux stratégies alternatives étaient proposées pour expliquer comment le PSII peut se protéger de l’excès de lumière : i) en diminuant le nombre de chlorophylles grâce à la migration d’une partie des complexes chlorophylle-protéine vers le
photosystème I (PSI). Ce processus est appelé « transition d’état »,
qT ; ii) en augmentant la dissipation thermique de l'énergie absorbée (
Figure). Ce processus est connu sous le nom de «
high energy quenching »,
qE.
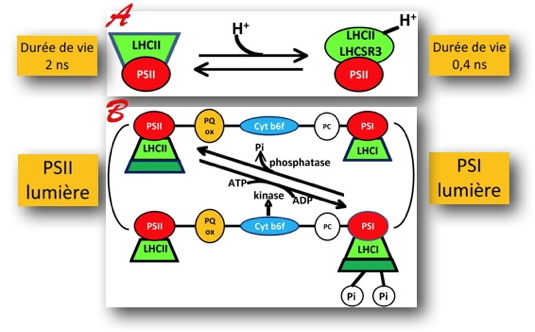
A : qE, dissipation thermique induite en forte lumière par la présence de LHCSR3 et l’acidification d’un compartiment interne du chloroplaste, le lumen des thylacoïdes. qE induit une désactivation plus rapide des états excités de la chlorophylle par dissipation non radiative.
B : qT est induit par un changement redox de la chaîne de transfert d’électrons photosynthétique. Il détermine la migration réversible d’une partie des complexes collecteurs de lumière du PSII vers le PSI (état 2) et vice-versa (état 1), suite à un processus de phosphorylation/déphosphorylation.
Dans une précédente étude, Giovanni Finazzi de l’
équipe D-Phy-Chloro du laboratoire de Physiologie Cellulaire & Végétale, avait montré que, chez la microalgue
Phaeodactylum tricornutumlum, le gène
LHCX-1 qui code la protéine LHCX-1 (membre de la famille LHCSR :
light-harvesting complex stress-related), offrait un avantage sélectif de croissance à cette diatomée. En se comportant comme un amplificateur naturel de dissipation d'énergie thermique, LHCX-1 fournit aux cellules un mécanisme essentiel permettant d'anticiper les changements brusques de la lumière sous-marine. Dans une nouvelle étude, Giovanni Finazzi
et col. montrent l’existence d’une synergie entre qT et qE chez la microalgue modèle
Chlamydomonas.
En combinant des approches de génétique, biologie moléculaire, biochimie et imagerie de fluorescence
in vivo, les chercheurs montrent que la protéine LHCSR3, responsable de l’activation de qE chez
Chlamydomonas peut migrer de façon réversible entre le PSII et le PSI pendant les transitions d’état. Cette migration réversible permet une régulation fine de la réponse à la lumière, et confère à cette algue une résistance aux stress lumineux largement supérieure aux plantes vasculaires. L’inhibition par ingénierie génétique des deux processus chez
Chlamydomonas se traduit par une production accrue d’espèces radicalaires de l’oxygène et par une réduction significative de la croissance cellulaire.
Cette étude fournit de nouveaux éléments nécessaires à la compréhension des bases du succès écologique des microalgues, et suggère des pistes pour améliorer leur croissance en condition de stress pour des applications futures en biotechnologie.
Le photosystème II est le centre de conversion photochimique qui est particulièrement sensible au stress lumineux. Le photosystème I, second centre photochimique, est quant à lui non photosensible.
Le chloroplaste contient un réseau de membranes ou thylacoïdes qui sont le siège de la phase lumineuse de la photosynthèse. L'espace intérieur délimité par les membranes du thylacoïde s'appelle le lumen.