Du statut de vestige inutile d’une structure ancestrale, le
cil primaire est devenu la nouvelle star de la biologie. C’est d’abord la découverte en 2000 que le gène déficient dans les cas de polycystose rénale codait pour des protéines d’assemblage du cil primaire qui l’a remit sur le devant de la scène
[2]. Puis ses capacités de capteur biomécanique ont été révélées dans les cellules rénales dans lesquelles il induit une entrée de calcium lorsque le flux externe le fait pencher
[3]. Mais c'est également la démonstration de son rôle de capteur biochimique qui explique l'excitation actuelle qu'il suscite. En effet, le cil est truffé de récepteurs capables de reconnaître spécifiquement certaines molécules biochimiques et d'activer les voies de signalisation intra-cellulaires correspondantes au cours du développement embryonnaire et du fonctionnement des tissus adultes
[4].
Depuis, le nombre identifié de processus cellulaires impliquant le cil primaire ne fait que croître et l’ensemble des maladies que son dysfonctionnement induit est maintenant regroupé sous le nom de ciliopathie
[5]. Son implication dans la différentiation des cellules et la régulation de leur prolifération lui fait naturellement jouer un rôle complexe mais déterminant dans l’apparition des tumeurs cancéreuses
[6, 7]. En effet, les cellules doivent quitter le cycle cellulaire pour que cet organite s’assemble et il doit se désassembler pour qu’elles puissent y retourner. Entre temps, il sonde les signaux biochimiques et mécaniques de l’espace extra-cellulaire. Il est d’ailleurs connecté à l’ensemble des trois grands réseaux du cytosquelette ainsi qu’à l’ensemble du système membranaire qui gère le trafic intra-cellulaire, ce qui lui permet de relier directement l’intégration des signaux extra-cellulaire et la gestion de l’organisation interne de la cellule.
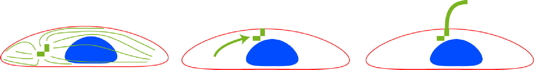
C’est ce rôle de clé de voûte de l’organisation intra-cellulaire qui a retenu notre attention. Le dogme actuel était que toutes les cellules entrant en quiescence assemblaient un cil primaire. Ces chercheurs ont montré que ceci n’était le cas que dans les cellules qui étaient confinées spatialement. Les cellules libres de s’étendre étaient incapables d’assembler le cil bien qu’elles aussi soient sorties du cycle cellulaire. En utilisant des techniques de micro-structuration de surface, ces chercheurs ont contrôlé le niveau d’étalement des cellules et montré que la forme cellulaire et l’architecture du réseau d’actine étaient des régulateurs majeurs du processus de ciliogenèse
[8]. Dans les cellules confinées spatialement, les cellules développent un réseau branché sur leur surface dorsale qui ressemble à un pôle apical de cellule épithéliale. Le centrosome migre vers ce pôle où il organise la croissance du cil primaire. Les cellules étalées sont beaucoup plus contractées. Elles développent de grosses fibres de stress sur leur surface ventrale. Le centrosome est attiré vers cette surface, sous le noyau, et le niveau de contraction empêche l’assemblage du cil.
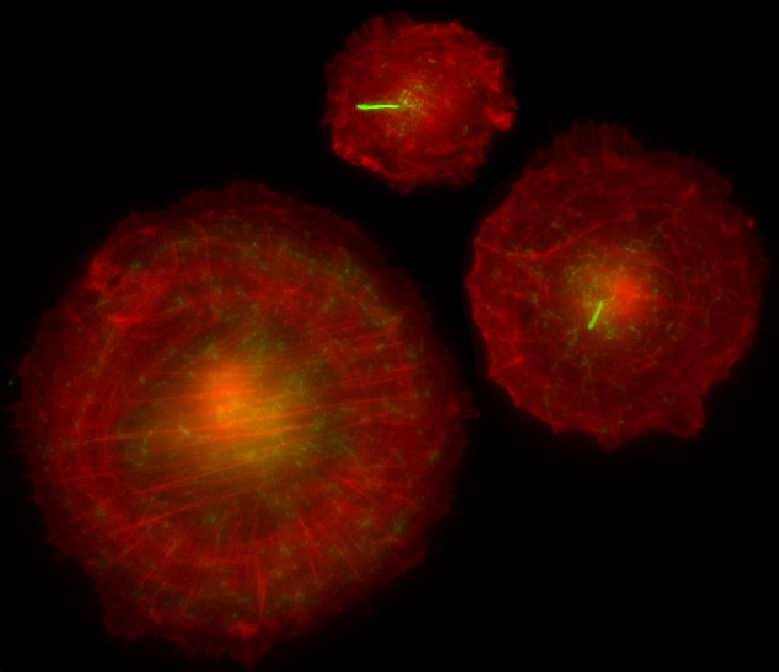
Cellules épithéliales de rétine dans lesquelles le marquage rouge montre le cytosquelette d'actine et le vert les microtubules qui constituent le cil primaire. Ce cil a disparu dans les cellules les plus étalées.
Par ailleurs, des expériences préliminaires récentes réalisées par ces chercheurs suggèrent que les cellules non ciliées sont plus promptes à retourner dans le cycle lorsqu’elles sont stimulées par des facteurs de croissance. Le maintien d’un faible niveau de contractilité cellulaire et la présence du cil primaire pourraient donc jouer un rôle déterminant dans la maintenance des cellules dans un état différencié, non prolifératif et donc non cancéreux.
Ces travaux montrent que le niveau de confinement spatial des cellules par leur microenvironnement affecte l'ensemble de leur organisation intra-cellulaire ainsi que leur capacité d'assembler un cil primaire et donc de recevoir les signaux externes. Ce type de régulation pourrait donc avoir d'importantes conséquences sur le fonctionnement des cellules au cours de la genèse des organismes comme au cours des transformations pathologiques comme le cancer.
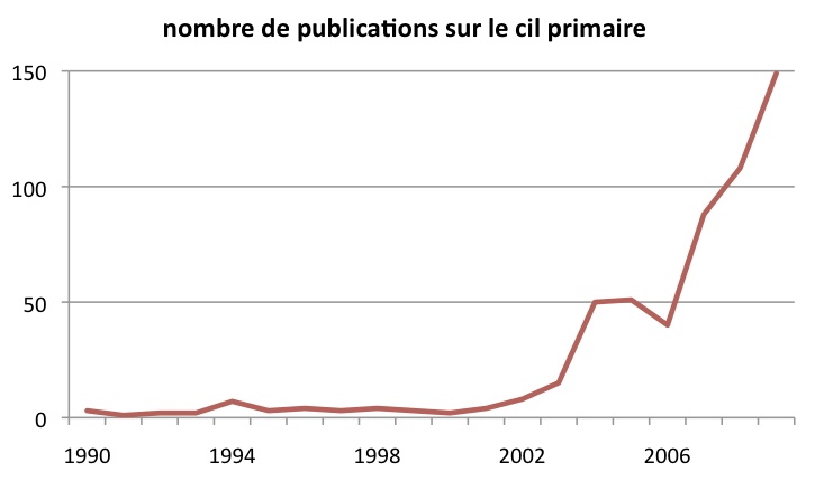
Le
cil primaire est un appendice cellulaire présent sur la quasi-totalité des cellules de notre corps. Son existence est connue depuis le début du XX ème siècle mais ce n’est que depuis quelques années que la communauté scientifique s’y intéresse fortement, comme en atteste l’évolution du nombre annuel de publication dans PubMed relatif à ce sujet.