Les nouvelles techniques pour visualiser et suivre le comportement temporel précis des molécules biologiques permettent une compréhension à l'échelle moléculaire (toujours plus sophistiquée) des processus cellulaires.
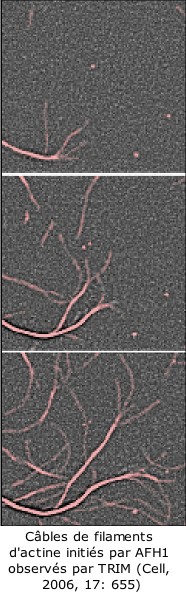 Les filaments d’actine sont des polymères biologiques essentiels à l’intégrité architecturale cellulaire. En effet, la croissance dynamique des filaments d’actine est responsable d’un grand nombre de processus biologiques, de la division à la migration cellulaire. En utilisant une technique appelée TIRFM (Total Internal Reflection Microscopy) des chercheurs de l'équipe CytoMorphoLab ont déterminé le mécanisme d’action d’un facteur de nucléation des filaments d’actine (formine AFH1) chez la plante modèle Arabidopsis thaliana. TIRFM permet la détection de molécules fluorescentes excitées à l’aide d’une onde évanescente générée à l’interface des échantillons biologiques avec le verre ou d'autres matériaux aux propriétés réfringentes semblables. En raison de la profondeur limitée qui peut être sondée par cette technique, elle est le plus souvent employée pour étudier des processus cellulaires au niveau de la membrane plasmique, comme la fusion de vésicules. Les auteurs ont adapté cette technique pour suivre en temps réel la polymérisation de filaments d’actine. Ces expériences ont été réalisées dans un système in vitro à trois composantes simples : les monomères d'actine, un facteur de nucléation (la formine AFH1), et la profiline (qui favorise l'addition des monomères d'actine aux extrémités les plus dynamiques du filaments). Quand AFH1 est attachée à la lame de verre, les filaments d’actine initiés par cette formine s’allongent à l’opposé du site de nucléation. Ceci indique qu'AFH1 est une formine nonprocessive, c'est-à-dire, qu’après la nucléation, AFH1 se déplace sur le côté du filament. Toutes les formines étudiées jusqu’à présent restaient associées à l’extrémité la plus dynamique du filament suivant un comportement processif. Les auteurs ont pu aussi montrer qu'AFH1 attachée sur le côté d’un filament préexistant était capable de nucléer un nouveau filament d’actine. AFH1 peut ainsi favoriser la formation de réseau parallèle de filaments d’actine.
Les filaments d’actine sont des polymères biologiques essentiels à l’intégrité architecturale cellulaire. En effet, la croissance dynamique des filaments d’actine est responsable d’un grand nombre de processus biologiques, de la division à la migration cellulaire. En utilisant une technique appelée TIRFM (Total Internal Reflection Microscopy) des chercheurs de l'équipe CytoMorphoLab ont déterminé le mécanisme d’action d’un facteur de nucléation des filaments d’actine (formine AFH1) chez la plante modèle Arabidopsis thaliana. TIRFM permet la détection de molécules fluorescentes excitées à l’aide d’une onde évanescente générée à l’interface des échantillons biologiques avec le verre ou d'autres matériaux aux propriétés réfringentes semblables. En raison de la profondeur limitée qui peut être sondée par cette technique, elle est le plus souvent employée pour étudier des processus cellulaires au niveau de la membrane plasmique, comme la fusion de vésicules. Les auteurs ont adapté cette technique pour suivre en temps réel la polymérisation de filaments d’actine. Ces expériences ont été réalisées dans un système in vitro à trois composantes simples : les monomères d'actine, un facteur de nucléation (la formine AFH1), et la profiline (qui favorise l'addition des monomères d'actine aux extrémités les plus dynamiques du filaments). Quand AFH1 est attachée à la lame de verre, les filaments d’actine initiés par cette formine s’allongent à l’opposé du site de nucléation. Ceci indique qu'AFH1 est une formine nonprocessive, c'est-à-dire, qu’après la nucléation, AFH1 se déplace sur le côté du filament. Toutes les formines étudiées jusqu’à présent restaient associées à l’extrémité la plus dynamique du filament suivant un comportement processif. Les auteurs ont pu aussi montrer qu'AFH1 attachée sur le côté d’un filament préexistant était capable de nucléer un nouveau filament d’actine. AFH1 peut ainsi favoriser la formation de réseau parallèle de filaments d’actine.
Ce travail fournit un exemple clair de la façon dont TIRFM peut être utilisée pour comprendre les mécanismes moléculaires contrôlant la dynamique de l'actine.